题组一物理变化与化学变化的判断
[挑战满分](限时10分钟)
1.下列物质的使用不涉及化学变化的是
A.明矾用作净水剂B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃D.生石灰作干燥剂
答案B
解析明矾作为净水剂的原因:溶于水电离出的铝离子发生水解,生成的氢氧化铝胶体具有强吸附性;氢氟酸能刻蚀玻璃的原因:氢氟酸与玻璃中的二氧化硅反应生成四氟化硅和水;生石灰作干燥剂的原因:生石灰与水反应生成氢氧化钙,以上物质的使用均涉及化学变化,A、C、D错误;液氨用作制冷剂的原因:液氨挥发吸热使周围环境温度迅速降低,不涉及化学变化,B正确。
2.下列各组变化中,前者是物理变化,后者是化学变化的是
A.碘的升华、石油的分馏
B.NH4Cl溶液除铁锈、食盐水导电
C.蛋白质溶液中加饱和(NH4)2SO4溶液、蓝色的胆矾常温下变白
D.热的饱和KNO3溶液降温析出晶体、二硫化碳洗涤试管内壁上的硫
答案C
解析选项A、D都是物理变化;选项B,两者都是化学变化,电解质溶液的导电过程就是电解的过程,电解必然会产生新物质,故食盐水导电是化学变化;蛋白质的盐析是物理变化,胆矾变白,说明胆矾失去结晶水,发生的是化学变化,选项C符合题意。
3.下列有关变化过程的叙述不正确的是
A.从海水中提取镁必须通过化学反应才能实现
B.用侯氏制碱法制纯碱必须通过化学反应才能实现
C.用"地沟油"纯化生产"生物燃油"的过程发生的是化学变化
D.激光法蒸发石墨得C60发生的是化学变化
答案C
解析从海水中提取镁的过程是Mg2+―→Mg(OH)2―→MgCl2―→Mg,其中发生了化学变化,A项正确;侯氏制碱法的过程是NaCl―→NaHCO3―→Na2CO3,其中发生了化学变化,B项正确;"地沟油"纯化是分馏的过程,发生的是物理变化,C项错误;石墨与C60的结构不同,在转化的过程中有旧化学键的断裂与新化学键的形成,发生的是化学变化,D项正确。
4.下列有关物质变化的说法正确的是
A.熔融态的Al2O3导电、12C转化为14C都属于化学变化
B.根据反应中的能量变化,将化学反应分为"化合、分解、复分解、置换"四类
C.一定条件下石墨转化为C60是化学变化
D.将盛有NO2气体的密封烧瓶,放入热水中气体颜色加深的变化是物理变化
答案C
解析A项,熔融态的Al2O3导电的同时,Al3+和O2-分别在阴阳两极放电是化学变化,12C转化为14C不是化学研究的范畴,不属于化学变化,错误;B项,依据反应物和生成物的种类可将化学反应分为化合、分解、复分解、置换四种类型,错误;C项,同素异形体之间的相互转化属于化学变化,正确;D项,2NO2(红棕色)N2O4(无色)ΔH0,放入热水中,颜色变化的原因是平衡移动,属于化学变化,错误。
5.下列过程中颜色变化与化学变化无关的是
A.银白色的金属铁研磨成铁粉后变成黑色
B.新切割开的金属钠的表面由银白色迅速变成暗灰色
C.红棕色的NO2通过装有水的洗气瓶后得到无色气体
D.浅黄绿色的新制氯水久置后变为无色
答案A
解析A项中发生颜色变化是光学现象的变化,故铁研磨成铁粉属于物理变化;B项中金属钠被氧化成了Na2O,属于化学变化;C项中NO2通过装有水的洗气瓶后生成了NO,属于化学变化;D项中新制氯水变为无色,是Cl2+H2OHCl+HClO平衡不断右移的结果,属于化学变化。
6.中华民族的发明创造为人类文明进步做出了巨大贡献。下列我国古代发明中,不涉及化学反应的是
A.打磨磁石制指南针B.烧结粘土制陶瓷
C.湿法炼铜D.铁的冶炼
答案A
解析A项,打磨磁石制指南针没有新物质生成。
7.中国汉语文化博大精深,很多成语体现了化学知识。下列成语中涉及到的主要变化不是化学反应的是
A.百炼成钢B.饮鸩止渴
C.铁杵磨针D.火上浇油
答案C
解析A项,百炼成钢有新物质铁生成;B项,饮鸩止渴使人中毒,发生蛋白质变性;C项,铁杵磨针没有新物质生成;D项,火上浇油发生燃烧有新物质生成。
8.我国古代文献资料中记载了大量的化学研究过程与成果。下列选项不涉及化学变化的是
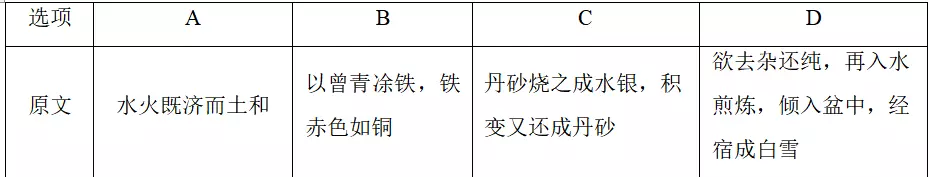
答案D
解析A项,水火既济而土和,即烧制陶瓷过程,陶瓷烧制过程中有新物质生成,属于化学变化;B项,"曾青"是指可溶性铜盐,即用铁将铜的化合物中的铜置换出来,有新物质生成,属于化学变化;C项,丹砂为硫化汞,不稳定,加热发生HgS分解生成Hg和S,温度降低时,又可发生Hg+S===HgS,该过程中有新物质生成,属于化学变化;
D项,重结晶过程是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程,没有新物质生成,属于物理变化。
9.下列变化不能说明发生了化学变化的是
A.变化时有电子的得失或共用电子对的形成
B.变化过程中有化学键的断裂和形成
C.变化时释放或吸收能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
答案C
解析A项,电子的得失或共用电子对的形成过程中有新物质生成,属于化学变化,故A错误;B项,化学键的断裂和形成说明有新物质生成,属于化学变化,故B错误;C项,物理变化时也能释放出能量,不能说明生成新物质,故C正确;D项,分子是保持物质化学性质的最小粒子,分子的种类变了,一定发生了化学变化,故D错误。
题组二常见无机反应类型的判断
[挑战满分](限时10分钟)
1.生物法净化含硫废气时发生如下反应:
。下列有关说法正确的是
A.反应中CH3COOH是还原剂
B.反应中SO被氧化
C.H2S的酸性比H2CO3强
D.该反应属于复分解反应
答案A
解析脱硫时硫元素的化合价由+6价降低到-2价,则硫元素被还原,SO为氧化剂,CH3COOH为还原剂,A项正确;B、D两项均错误;若H2S的酸性比H2CO3强,则应生成H2CO3和HS-(或S2-),C项错误。
2.某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是
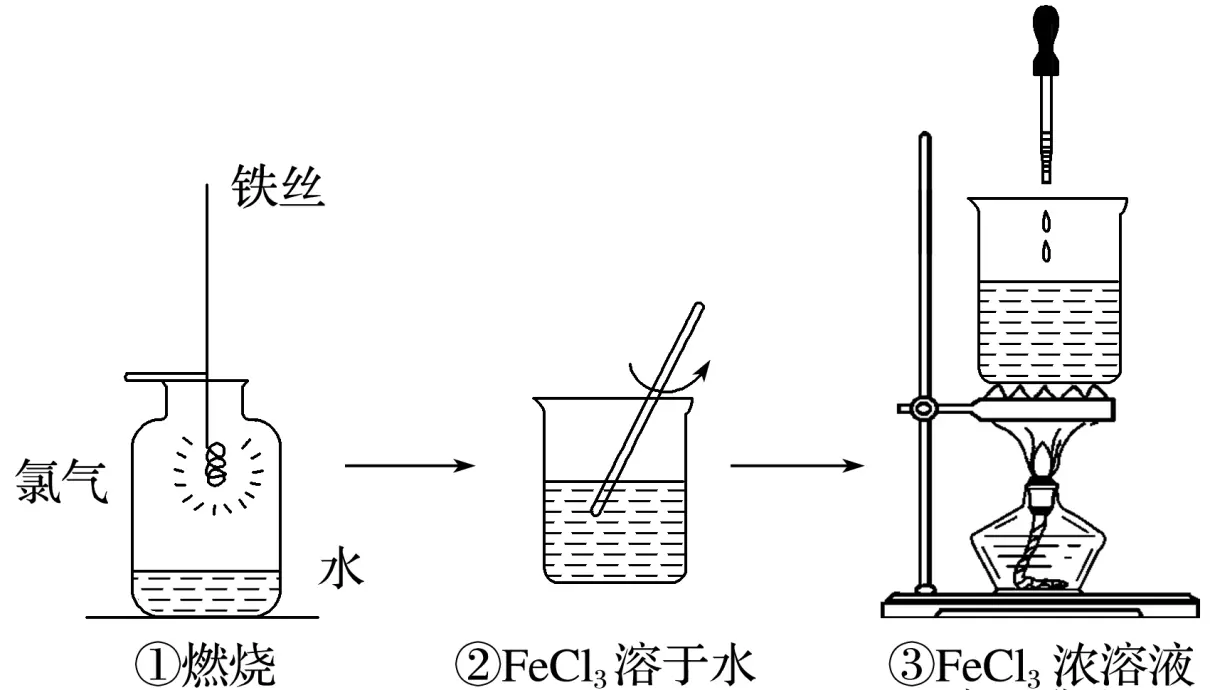
A.实验①、③反应制得的物质均为纯净物
B.实验②、③均未发生氧化还原反应
C.实验②、③均为放热反应
D.实验①、②所涉及的物质均为电解质
答案B
解析实验③制得的胶体为混合物,A选项错误;实验②氯化铁溶于水属于物理变化,实验③中发生的水解反应属于复分解反应,B选项正确;实验②属于物理变化,该过程中放热,实验③为吸热反应,C选项错误;实验①所涉及的Fe、Cl2都不是电解质,D选项错误。
3.如图是某燃煤发电厂处理废气的装置示意图。装置内发生的主要反应中不含
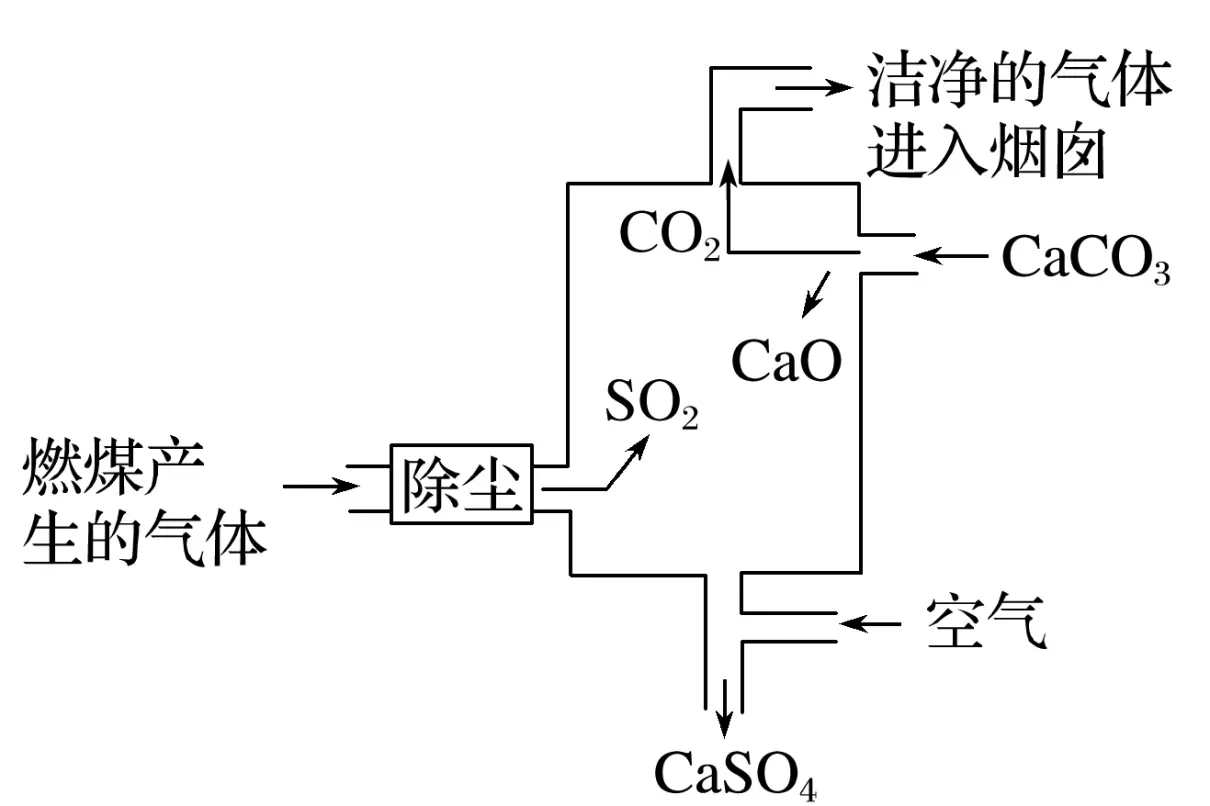
A.化合反应B.分解反应
C.置换反应D.氧化还原反应
答案C

4.下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液为中性⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥B.②④⑤⑥
C.①②③⑤D.③④⑤⑥
答案A
解析CO2+2NaOH===Na2CO3+H2O,①可以实现;H2S+CuSO4===CuS↓+H2SO4,②可以实现;CH3COONa+HCl===CH3COOH+NaCl,③可以实现;H2SO3+2H2S===3S↓+3H2O,④可以实现;3O2===2O3,⑤可以实现;3NO2+H2O===2HNO3+NO,⑥可以实现。
5.下表中有关变化和反应的对应关系正确的是
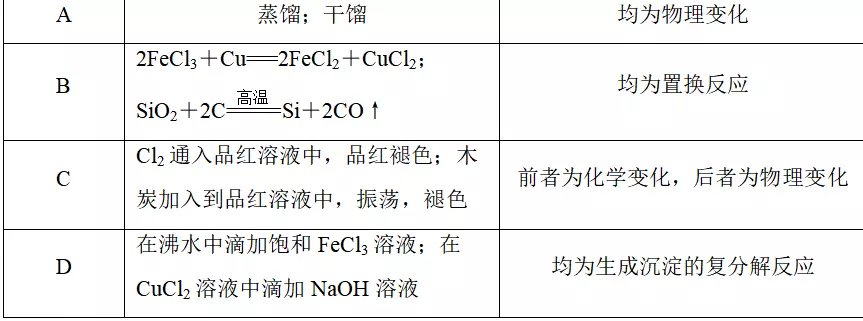
答案C
解析干馏是化学变化,A项错误;2FeCl3+Cu===2FeCl2+CuCl2不是置换反应,B项错误;木炭使品红溶液褪色的原因是木炭的吸附作用,属于物理变化,C项正确;在沸水中滴加饱和FeCl3溶液生成Fe(OH)3胶体,不是沉淀,D项错误。
6.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为
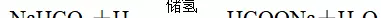
。下列有关说法正确的是
A.储氢过程中,NaHCO3被氧化
B.释氢过程的本质是盐类的水解
C.储氢、释氢过程均无能量变化
D.HCOONa晶体中既含有离子键又含有共价键
答案D
解析A项,储氢过程中C元素的化合价由+4降低为+2;B项,盐类水解是形成盐的阳离子与水电离的氢氧根结合,阴离子与水电离的氢离子结合,生成酸与碱的过程;C项,化学变化中一定伴随能量变化;D项,HCOONa晶体是离子晶体,由Na+与HCOO-构成,HCOO-中含有共价键。
7.中学化学中很多"规律"都有其使用范围,下列根据有关"规律"推出的结论合理的是
A.根据氧化还原反应的规律,推出强氧化剂遇到强还原剂一定会发生氧化还原反应
B.根据化学反应的规律,推出氢氧化铁可通过化合反应得到
C.根据元素的非金属性较强,其单质也越活泼规律,推出磷单质比N2稳定得多
D.根据CO2通入Ba(NO3)2溶液中无沉淀的规律推测,SO2通入Ba(NO3)2溶液中也无沉淀产生
答案B
解析A项,一般强氧化剂遇到强还原剂可以发生氧化还原反应,但同种元素之间必须有中间价态才能发生;B项,氢氧化铁可以由氢氧化亚铁、氧气和水发生氧化还原反应得到;C项,氮元素非金属性大于磷,由于N2存在NN三键,N2很稳定;D项中SO2可被酸化的NO氧化为SO,会产生BaSO4沉淀。
8.一种借用CeO2/CeO2-δ的转化,利用CO2和H2O合成燃料的途径如下图所示。下列说法不正确的是
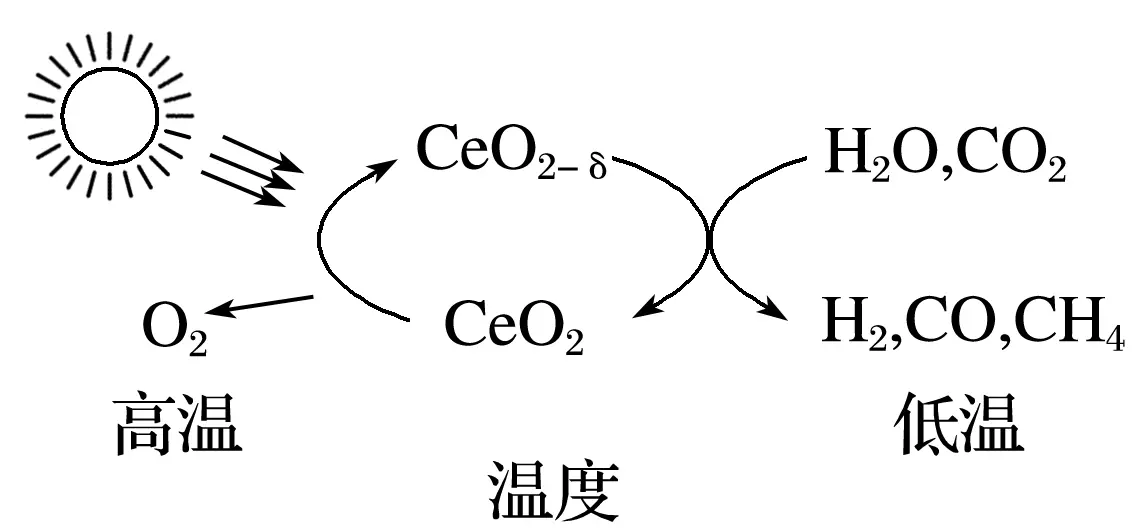
A.上述转化的实质是太阳能转化为化学能
B.若得到三种产物H2、CO、CH4各1mol,共放出O2为1mol
C.利用上述转化有利于遏制温室效应
D.上述转化过程中涉及的反应均属于氧化还原反应
答案B
解析B项中氧原子不守恒,故不正确;C项,图示中CO2被燃烧,能遏制温室效应,正确;D项中每步变化中均有单质生成,有元素化合价的变化,正确。
9.下列有关事实及原理分析都正确的是
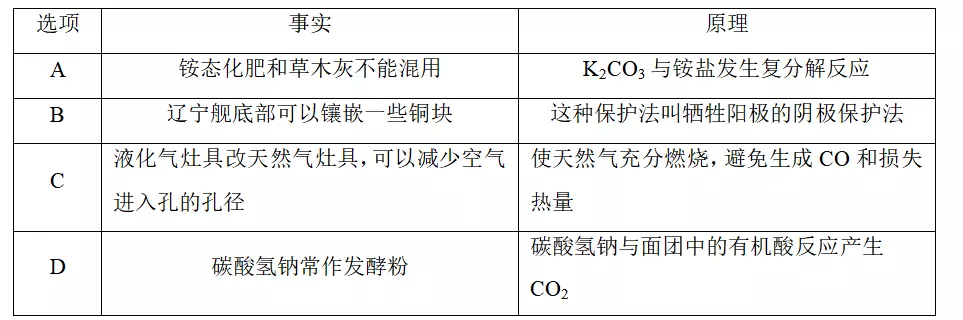
答案D
解析A项,草木灰的有效成分为碳酸钾(K2CO3),K2CO3溶液显碱性,OH-可与铵盐发生反应,导致氮元素损失,不是K2CO3和铵盐直接发生复分解反应,原理分析错误;B项,辽宁舰主要由钢材料制造,舰底镶嵌一些比较活泼的金属,如镁、锌等,在海水中构成原电池,较活泼金属作负极被腐蚀,钢材料作正极被保护,如果镶嵌铜块,铜为正极,钢为负极,会加快钢的腐蚀,错误;C项,相同状况下,同体积的天然气燃烧比液化气燃烧消耗的氧气少,液化气灶具改天然气灶具时需减小空气进入孔的孔径,避免天然气随空气流失而降低热量利用率,原理分析错误;D项,碳酸氢钠与酸反应生成CO2,使面团产生气孔,正确。
10.氢气是一种绿色能源,大力开发氢能有利于环境保护。借助Cu/CuCl热化学循环制氢:2H2O===2H2↑+O2↑,其工艺流程如下。下列有关说法正确的是
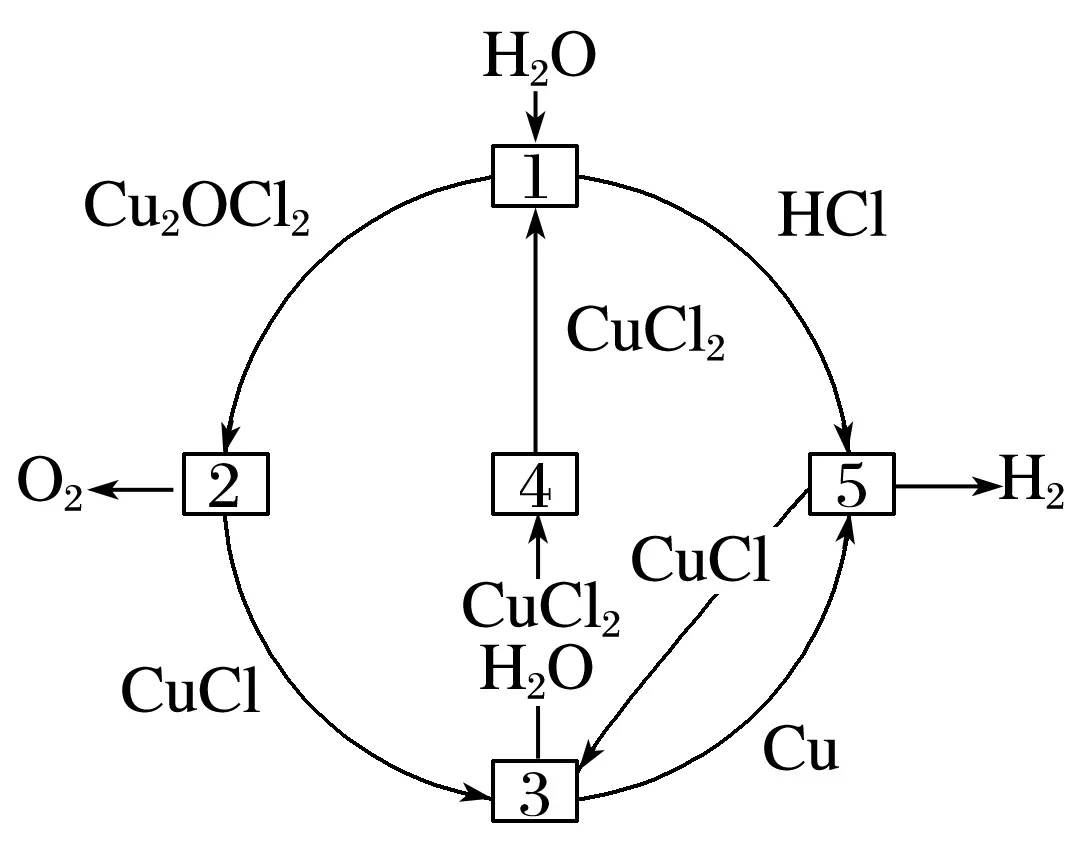
A.步骤①中发生的反应属于放热反应
B.步骤②的温度为500℃,则反应的化学方程式为
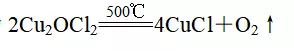
C.步骤③可在电解池中进行,Cu是氧化产物
D.反应⑤一定是依据原电池原理实现的
答案B
解析由图示看出①为CuCl2的水解反应,水解反应一般是吸热反应,A错误;②依据图示可知反应物Cu2OCl2,生成物为CuCl和O2,故B正确;③从CuCl―→Cu化合价降低,发生还原反应,C错误;⑤中Cu与HCl产生H2,为非自发的氧化还原反应,依据原电池原理无法实现该反应,D错误。
题组三离子反应的综合判断
1.命题时常用的设错方式
(1)反应不符合客观事实。
(2)反应不符合题设条件(如:滴加顺序、反应物量的问题)。
(3)不配平(漏掉不起眼的离子,电子、电荷、质量不守恒)
2.离子方程式判断题的答题流程
第一步:分析离子反应是否符合客观事实
(1)只有实际发生的离子反应才能书写离子方程式。
(2)离子方程式中的化学式、各种符号及反应产物必须符合实验事实,不能随意捏造。
第二步:判断生成物对不对
(1)变价元素的生成物(高价还是低价)。
(2)量不同时的生成物(某反应物过量是否会与生成物再反应)。
(3)反应物滴加顺序不同时的生成物。
逐滴加入试剂时,不同时段的生成物。
第三步:分析离子方程式平不平
(1)原子是否守恒。
(2)电荷是否守恒。
(3)氧化还原反应中电子得失是否守恒。
[挑战满分](限时15分钟)
1.FeCl3溶液是实验室中使用较为广泛的一种试剂,下列有关FeCl3溶液的作用或实验现象解释合理的是
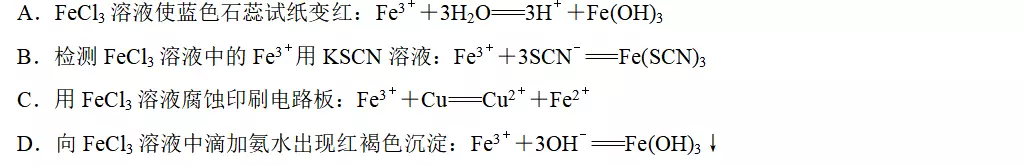
答案B
解析FeCl3溶液使蓝色石蕊试纸变红是因为Fe3+的水解,水解反应为可逆反应,A项不合理;检测FeCl3溶液中的Fe3+,应用SCN-,二者发生反应生成红色的Fe(SCN)3,B项合理;电荷不守恒,正确的离子方程式为2Fe3++Cu===Cu2++2Fe2+,C项不合理;NH3·H2O为弱电解质,在离子方程式中不能拆写,D项不合理。
2.下列反应的离子方程式书写不正确的是
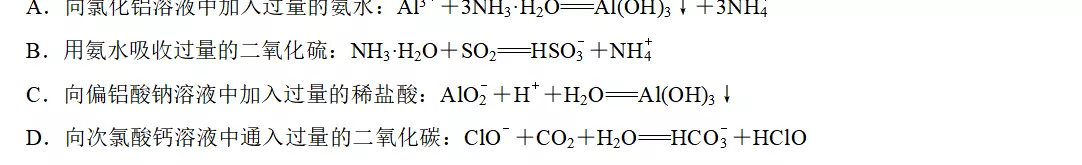
答案C
解析氨水不能溶解Al(OH)3,A项不符合题意;用氨水吸收过量的SO2,生成NH4HSO3,B项不符合题意;向偏铝酸钠溶液中加入过量稀盐酸,发生反应AlO+4H+===Al3++2H2O,C项符合题意;向次氯酸钙溶液中通入过量的二氧化碳,生成HClO和Ca(HCO3)2,D项不符合题意。
3.下列离子方程式书写正确的是
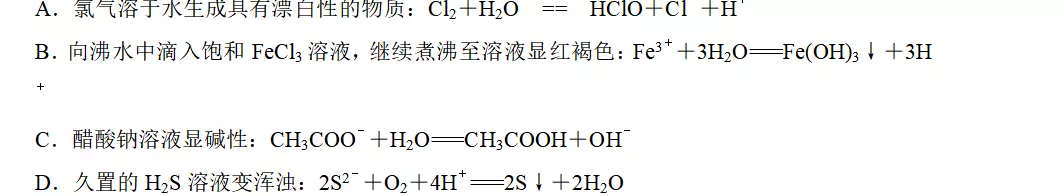
答案A
解析氯气溶于水生成HCl和HClO(弱酸),A项正确;向沸水中滴入饱和FeCl3溶液,继续煮沸至溶液显红褐色,生成Fe(OH)3胶体,不是沉淀,B项错误;水解为可逆反应,C项错误;H2S为弱酸,不能拆写,D项错误。
4.能正确解释下列反应原理,并且书写正确的离子方程式是

答案D
解析A项应生成Al(OH)3胶体,且不能写等号,应写可逆号;B项中小苏打的HCO不能拆开;C项,电解饱和MgCl2溶液得到氢氧化镁沉淀。
5.下列有关NaClO和NaCl混合溶液的叙述正确的是

答案D
解析NaClO和NaCl的混合溶液中含有ClO-,其在酸性条件下具有强氧化性,与H+和Br-不能大量共存,A项错误;混合溶液中的Cl-与Ag+反应生成氯化银沉淀,不能大量共存,B项错误;溶液为碱性,滴入少量硫酸亚铁时,亚铁离子被ClO-氧化,但离子方程式中不能写H+而应写水,且生成Fe(OH)3,C项错误;向溶液中加入浓盐酸时发生反应:ClO-+Cl-+2H+===Cl2↑+H2O,每产生1molCl2转移1mol电子,约为6.02×1023个,D项正确。
6.下列反应的离子方程式书写正确的是

答案D
解析氨水是弱电解质,书写离子方程式时不能拆开,应写化学式,A项错误;应是水参与反应而不是OH-,且生成的是锰离子而不是二氧化锰,B项错误;电解饱和MgCl2溶液,应生成氢气、氯气和氢氧化镁沉淀,C项错误;次氯酸根离子将亚硫酸根离子氧化为硫酸根离子,自身被还原为氯离子,D项正确。
7.一定能在下列溶液中大量共存的离子组是

答案A
解析B项,SO、CO和Ca2+生成沉淀不能大量共存;C项,SCN-和Fe3+因发生络合反应不能大量共存;D项,H+、Fe2+、NO因发生氧化还原反应不能大量共存。
8.下列各组离子或分子在溶液中能大量共存,且满足相应要求的是
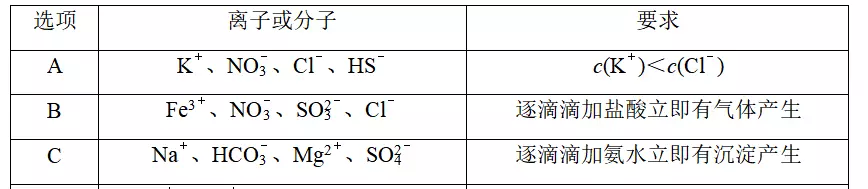
答案C
解析不符合溶液电中性原理,A项错误;Fe3+与SO不能大量共存,B项错误;滴加氨水开始产生MgCO3沉淀,后产生Mg(OH)2沉淀,C项正确;滴加NaOH浓溶液会先和醋酸反应,不会立刻产生气体,D项错误。
9.在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
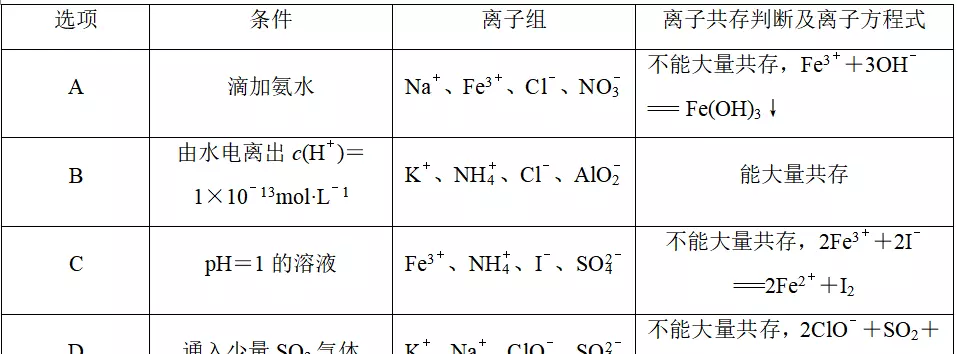
答案C
解析滴加氨水,离子组中的Fe3+与氨水反应生成Fe(OH)3沉淀,不能大量共存,氨水应写化学式,离子方程式书写错误,A项错误;因由水电离出的c(H+)=1×10-13mol·L-1的溶液可能呈酸性,也可能呈碱性,在酸性溶液中AlO不能大量共存,在碱性溶液中NH不能大量共存,B项错误;酸性溶液中Fe3+与I-发生氧化还原反应而不能大量共存,C项正确;SO2与ClO-不能大量共存,二者会发生氧化还原反应生成SO,D项错误。
10.某溶液可能含有Na+、NH、Ba2+、SO、I-、S2-中的几种离子。进行如下检测:①用pH计检测,溶液显弱酸性;②加新制氯水和淀粉溶液无明显现象。为确定该溶液的组成,还需检验的离子是
A.Na+B.Ba2+
C.SOD.S2-
答案A
解析实验①说明溶液中含有NH(水解使溶液显弱酸性);实验②说明溶液中无I-、S2-,再根据电荷守恒可推出该溶液中含有SO,则Ba2+不能存在;至于是否含有Na+,需要进一步检验。
11.下列粒子在相应条件下可大量共存的是
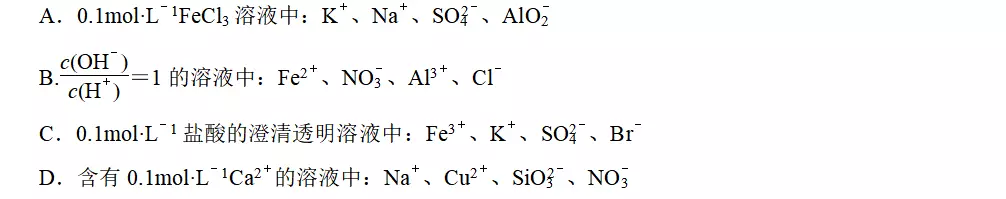
答案C
解析A项,Fe3+与AlO发生双水解反应,生成Fe(OH)3和Al(OH)3沉淀;B项,条件实质是溶液呈中
性,Fe2+、Al3+在中性条件不能大量共存;C项,附加条件是澄清透明、酸性溶液,澄清透明是溶液的特征,不能把澄清透明误认为无色溶液,C项正确;D项,Ca2+、Cu2+与SiO都不能大量共存。
12.下列指定反应的离子方程式正确的是
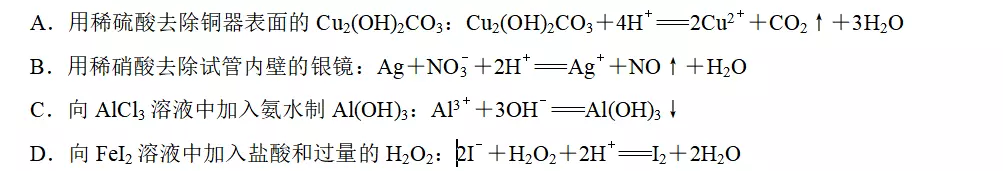
答案A
解析B项得失电子不守恒,应该为3Ag+NO+4H+===3Ag++NO↑+2H2O,错误;氨水为弱电解质,不能拆成离子形式,C项错误;忽略了Fe2+与H2O2发生的氧化还原反应,D项错误。
13.下列反应的离子方程式书写正确的是

答案B

题组四常见无机物之间转化关系的综合判断
[挑战满分](限时10分钟)

A.①②④B.②③
C.①④⑤D.③④
答案D
解析①Fe与O2反应可生成Fe2O3或Fe3O4;②若NaOH不足,只有HCO参与反应,生成Na2CO3和(NH4)2CO3,若NaOH过量,生成Na2CO3和NH3·H2O;⑤当碳少量时生成Si和CO,当碳足量时生成SiC和CO。
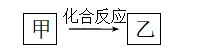
2.一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,则乙可能是
A.Al(OH)3B.H2SiO3
C.FeCl2D.CH3Cl
答案C
解析氢氧化铝可由氯化铝与氨水反应生成或由偏铝酸钠和氯化铝反应生成,但两者均不是化合反应,A项错误;硅酸可由硅酸钠与盐酸反应得到,但不能通过化合反应获得,B项错误;氯化铁与铁单质发生化合反应可以生成氯化亚铁,属于化合反应,C项正确;甲烷与氯气发生取代反应可生成CH3Cl,但不属于化合反应,D项错误。
3.已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略)。
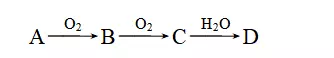
下列说法不正确的是
A.若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2∶3
B.若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第ⅣA族
C.不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化
D.若A是共价化合物,0.1molA分子中含有的电子数可能为NA(NA为阿伏加德罗常数的值)
答案B
解析A项,当转化关系为N2―→NO―→NO2―→HNO3时,A为N2,与Mg反应生成的Mg3N2中阴、阳离子个数比为2∶3,正确;B项,若A为碳,则对应的D为H2CO3,属于弱电解质,错误;当转化关系为H2S(或S)―→SO2―→SO3―→H2SO4时,C项正确;当转化关系为NH3―→NO―→NO2―→HNO3时,D项正确。
4.下列物质的转化在给定条件下能实现的是
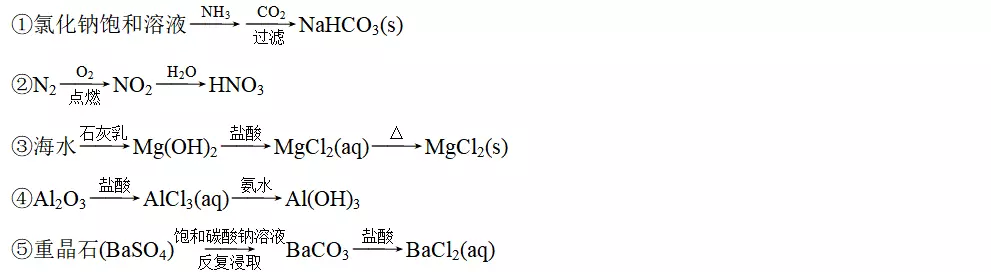
A.①③⑤B.②③④
C.②④⑤D.①④⑤
答案D
解析②N2在点燃的条件下不能生成NO2;③MgCl2易水解,加热蒸干不能得到无水MgCl2,得到的生成物可能是Mg(OH)2。
5.一定条件,在水溶液中1molCl-、ClO的能量相对大小如图所示。下列有关说法中正确的是
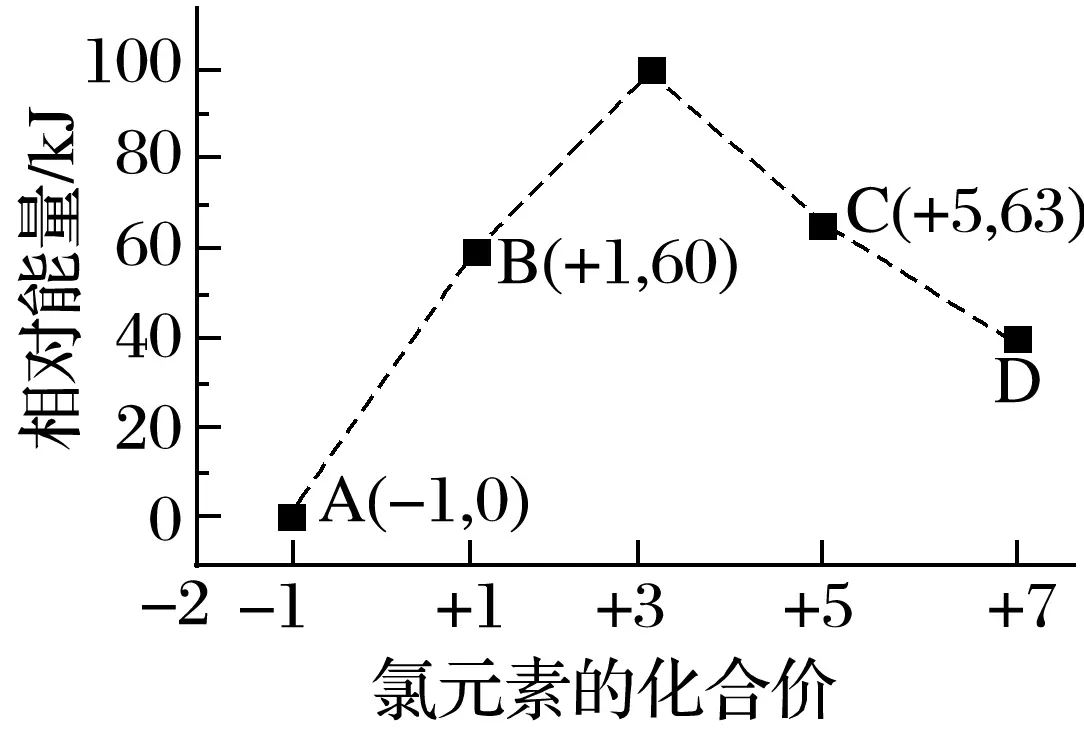
A.D是ClO
B.B―→A+C反应的活化能为60kJ·mol-1
C.A、B、C、D中C最稳定
D.B―→A+C反应的热化学方程式:

-1
答案D
解析由图可知D中氯元素化合价为+7,D是ClO,A项错误;由图可知,60kJ是B的相对能量,不是B―→A+C反应的活化能,B项错误;A、B、C、D中A的相对能量最低,最稳定,C项错误。
6.根据如图所示的信息,判断下列叙述不正确的是
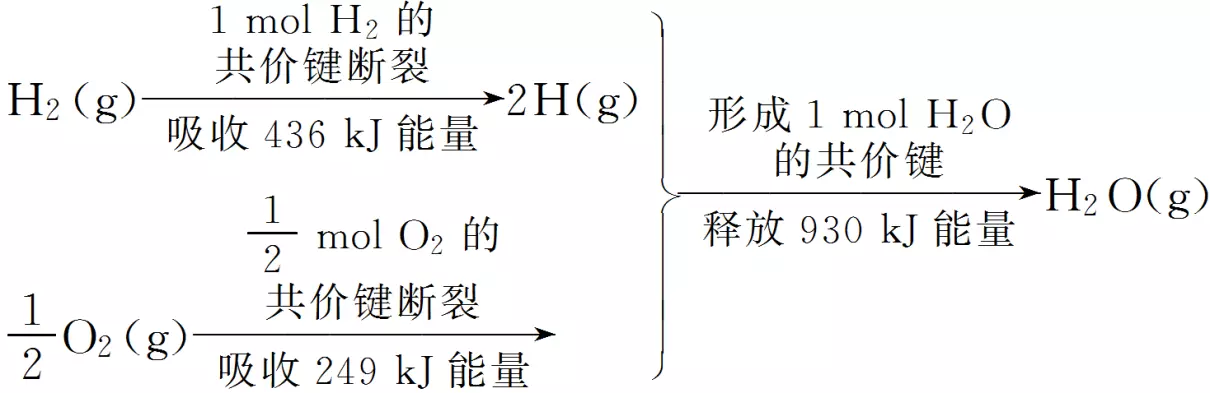

答案B
解析对同一个化学键来说,断裂时吸收的能量与形成时放出的能量相等,A正确;H2在O2中燃烧为放热反应,B错误;反应物断键吸收的热量Q吸=436kJ+249kJ=685kJ,生成物形成时放出的热量Q放=930kJ,故该反应放出的热量Q=245kJ,C正确;放热反应的反应物总能量大于生成物的总能量,D正确。
7.A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系。A为一种金属单质,其产量直接关系国民经济命脉。反应①②③均为化合反应,反应④为置换反应。下列有关说法不正确的是
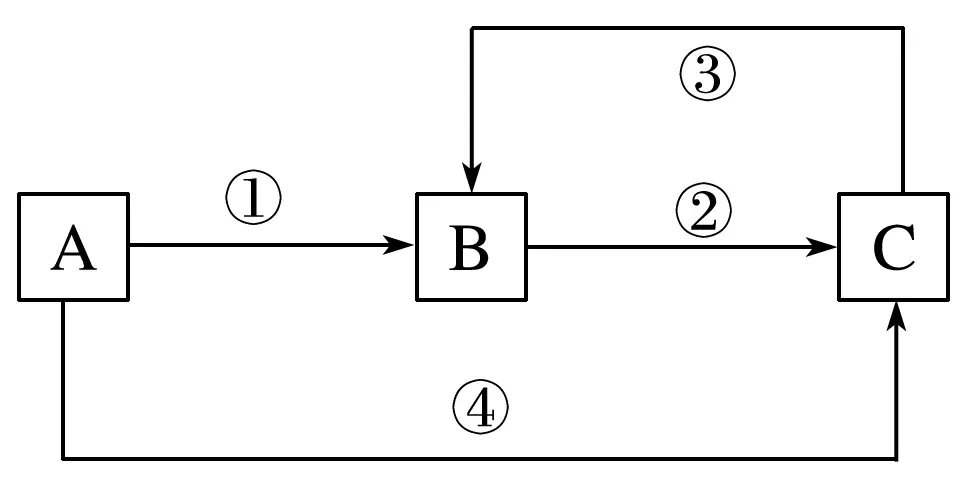
A.①中所加试剂可能是氯气
B.③中需要加具有氧化性的试剂
C.A与稀硝酸反应一定能实现元素M在①中发生的价态变化
D.元素M在②中发生的价态变化也能通过加碘化钾溶液实现
答案C
解析根据转化关系可确定A为变价金属,应为Fe,反应①加入氯气能实现,B为FeCl3,C为FeCl2,A项正确;反应③是铁元素由+2价升高到+3价,需要加具有氧化性的试剂,B项正确;过量的铁与稀硝酸反应时,生成硝酸亚铁,C项错误;Fe3+能将I-氧化成I2,自身被还原成Fe2+,D项正确。
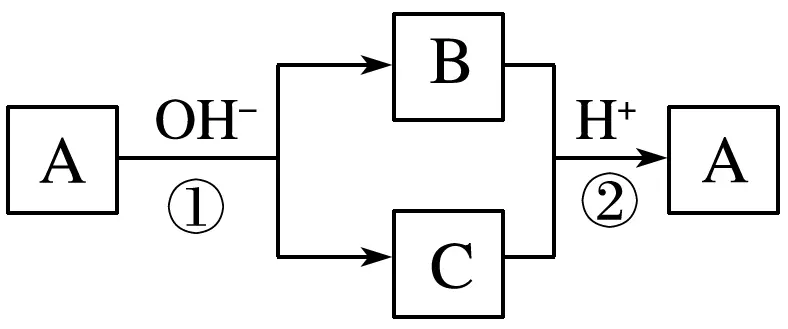
8.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系。下列判断正确的是
A.X元素可能为Al
B.反应①和②互为可逆反应
C.X元素可能为Si
D.反应①和②一定为氧化还原反应
答案D
解析从框图可以看出元素X应该有变价,反应①和②都属于氧化还原反应;Al和Si均无变价;反应①和②分别在碱性和酸性条件下进行,不是可逆反应,元素X可能为氯、溴、碘等元素。
9.海洋中有丰富的矿产、能源和水产资源,如图所示为利用海水的部分流程。
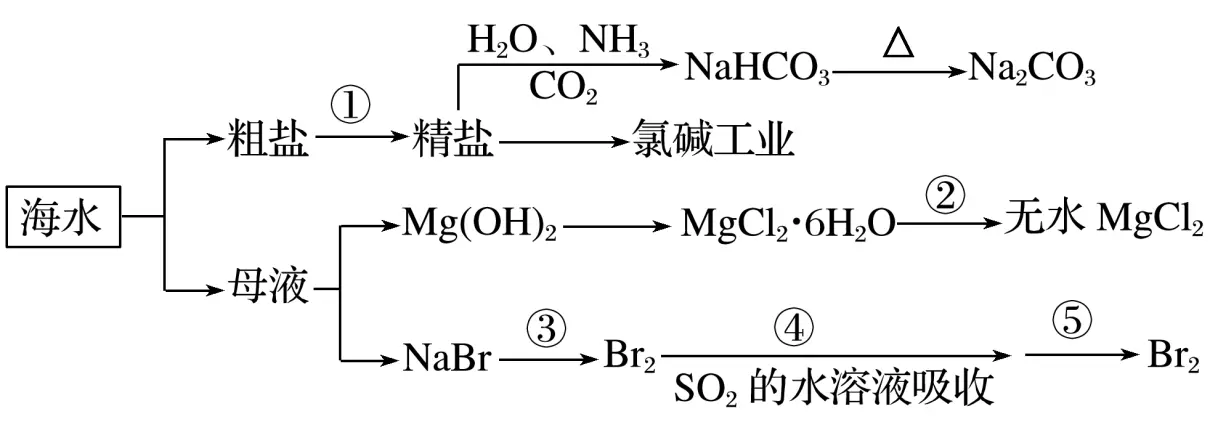
下列有关说法正确的是
A.制取NaHCO3的原理是利用其溶解度比较小
B.用澄清石灰水可鉴别NaHCO3和Na2CO3
C.在③④⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
答案A
解析A项中发生的反应为CO2+H2O+NH3+NaCl===NaHCO3↓+NH4Cl,反应能够发生是因为NaHCO3
的溶解度比较小,A正确;B项中石灰水与NaHCO3和Na2CO3反应都能产生碳酸钙沉淀,不能用于鉴别两种物质,B错误;C项中④步骤中SO2+2H2O+Br2===H2SO4+2HBr,溴元素被还原,C错误;D项中工业上制取金属镁采用电解熔融MgCl2,不是电解饱和MgCl2溶液,D错误。
10.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
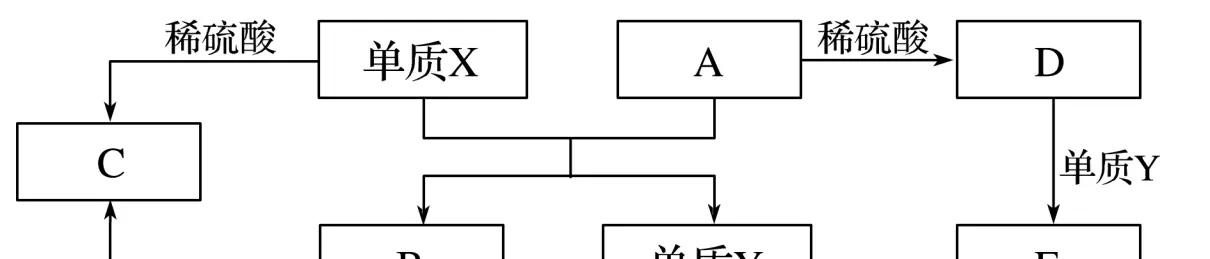
则下列说法正确的是
A.单质X与A反应的化学方程式:Al2O3+2FeFe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-===Fe(SCN)3↓
C.单质X和单质Y在一定条件下均能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性化合物
答案C
解析分析题中的转化关系图可推得单质X为Al,氧化物A为Fe2O3,单质Y为Fe,氧化物B为Al2O3,C为Al2(SO4)3,D为Fe2(SO4)3,E为FeSO4。A项,单质X与A反应的化学方程式是Fe2O3+2AlAl2O3+2Fe;B项生成的Fe(SCN)3不是沉淀;D项,化合物C是硫酸铝,不是两性化合物。